Originariamente inviato da zagami
Visualizza il messaggio
annuncio
Comprimi
Ancora nessun annuncio.
Prova di assemblaggio pila Zinco-Aria alcalina
Comprimi
X
-
Il foro per l'ingresso di ossigeno può essere con una superficie dell'1% rispetto all'elettrodo, non serve grande areazione, e va fatto in modo che possa essere chiudo, perchè altrimenti quando la batteria è inutilizzata potrebbero formarsi perossidi che andrebbero a consumare lo zinco.
-
Se hai gelificato non ti accorgi, in quanto non a caso ho detto di mettere carbossimetilcellulosa, perchè il gel una volta formato il primo strato sueperficiale di idrogeno ostacola la successiva formazione, ti assicuro che anche a PH13 si consuma, non avrebbe senso che la Duracell usa additivi e anche gli altri, purtroppo poco a poco si consuma, e non lo vedi a occhio se non usi polvere fine, prova a immergere un pò di polvere in un bicchierino di koh a ph13 e vedi il giorno dopo.
Commenta
-
la KOH è 8M la prova l'ho fatta prima di assemblare la pila ovviamente non ho usato gelificanti
non ho usato gelificanti
8 molare vuole dire circa il 50% di potassa caustica ...presente la densita' e soprattutto la sua viscosita'? ...le concentrazioni elevate molte volte, impediscono le reazioni chimiche stesse , per il basso coefficiente di attivita' delle medesime
esempio . l'acido solforico diluito attacca il ferro puro, mentre se concentrato no
il cromo si scioglie nell'acido solforico diluito, mentre no si scioglie nel solforico conc
il cobalto non si scioglie nell'acido nitrico conc , ma si scioglie nel diluito
il Nichel come sopra
etc etc..
Commenta
-
credimi, anche a 8M mi si consuma, e quando la concentrazione aumenta ancora lo zinco alla fine su ossida completamente in pochi giorni, e mi rimane un pastocco bianco. Parlo sempre di polvere fine, dove la superficie a contatto con l'elettrolita è enorme, e ricorda che non vedrai mai ossido di zinco fino a che il koh è saturo, e nel tuo caso al 50% a voglia ora che si satura....
Commenta
-
mr, non vedi che quello zinco è letteralmente ossidato? è un mix di ossido e zinco, si vede a occhio... per toglierti lo sfizio buttalo in una zoluzione di solforico al 5% e vedrai come scopare quell'alone bianco.
aparte il fatto che hai utilizzato un filo di rame a contatto con lo zinco, e questo però mi delude, in quanto il rame in quella circostanza si ossida, deposita ioni in kho che vengono poi ridotti sullo zinco a CuO (che ovviamente non vedi in quanto è una roba minima), questo non è proprio un test ne affidabile ne ben fatto, scusa la contestazione ma è doverosa, qui si deve lavorare necessariamente con reagenti di alta purezza e con criteri ben precisi, se non si adottano questi accorgimenti ogni prova verrà letteralmente falsata, mai mettere rame e zinco a contatto in un elettrolita.
il metallo di supporto per lo zinco deve essere STAGNO puro, mentre quello del carbone deve essere NICHEL puro.
Commenta
-
è cavolo mr, come fai a fare un test efficiente in una circostanza simile? ogni elettrodo deve essere ben curato, lo zinco deve essere compattato con un legante, il carbone attivo va amalgamato con un legante idrofobo(PTFE) e blindato anche nel PTFE dal lato aria perchè se no ti si secca tutto in breve tempo, va stampato a caldo, la distanza tra gli elettrodi deve essere il minimo possibile, il separatore deve essere di tipo sintetico non carta, eventualmente nitrocellulosa o lana di roccia, le misure e il peso dei catodi devono essere annotati, la tensione iniziale, quella finale, il carico applicato, la potenza erogata in base alla curva di scarica, insomma ci sono molti parametri che purtroppo vanno curati moltissimo e devono essere tassativamente presi in considerazione, questi sono dei test che necessitano di una cura maniacale per dare risultati attendibili, e come dicevo tempo fà, le pile zinco-aria proprio per queste ragioni sono una tragedia, perchè oltre ai classici problemi che puoi avere come per la realizzazione di un alkalina, te ne trovi altri 50 per via del fatto che è di tipo aria.Ultima modifica di tecnonick; 14-09-2013, 22:15.
Commenta
-
non è carta comune , ma carta da laboratorio utilizzata per filtrare acidi e basi concentrati , l'unico errore puo' essere dato dal rame a contatto dello zinco .. e te ne do' atto , ma da li' a dire che non è una prova sperimentale ne passa. Poi se vuoi insegnarmi ancora qualcosa di chimica , per le prossime reazioni che faccio in lab , chiedero' a te
Commenta
-
sai, quando ho iniziato a studiare i supercondensatori e ho fatto del prove, se pur fatte alla perfezione continuavo a non capire perchè si verificava un autoscarica piuttosto rapida e come mai la tensione non si manteneva al di sopra di 0,95V, infatti analizzando l'esempio di un banalissimo supercondensatore composto da due elettrodi in carbone attivo immersi in una soluzione di koh 30%, ci si aspetterebbe un condensatore a doppio strato la cui tensione dovrebbe tenere anche fino a 1,1V, eppure questo non accade, perchè? molto semplice: se il carbone attivo contiene delle impurità come ad esempio dei solfati(i più probabili vista la tipologia di produzione dei classici carboni attivi economici) quando dai tensione nel catodo si depositano sotto forma di metalli ed ecco che se pur in percentuale irrisoria il tutto si trasforma in una sorta di batteria a chissà quali metalli, e quindi la tensione finale è quella che avresti dal metallo maggiormente presente rispetto al carbone, tanto per capirci se usi un elettrodo di rame e uno di carbone difficilmente la cella manterrà una tensione superiore a 0,4V, quindi ipotizza che nel carbone c'è del rame, la tensione inizialmente sale perchè la quantità è irrisoria, ma in breve tempo tende a stabilizzarsi a quella che dovrebbe essere realmente. Per questo motivo, il carbone attivo che viene utilizzato per i supercondensatori e per gli elettrodi delle zinco-aria è di una purezza estrema, e costa una caterba di soldi! Nell'elettrochimica purtroppo se le cose non si fanno con precisione estrema non si potrà mai avere un risultato valido, vanno considerati tutti i possibili fattori che potrebbero falsare le prove, anche i più impensabili.
Mi spiace che te la prendi, ma l'esperimento che hai fatto in quella bottiglia non può essere considerato un esperimento, abbi pazienza... non ti devo insegnare nulla, ho mai detto questo? sicuramente sei più esperto di me, ma permettimi di farti notare questi errori, che in questo campo sono errori enormi.
Commenta
-
E' ok, ma la realizzazione strutturale è disastrosa, non è stato applicato alcun accorgimento necessario, scusami ripeto non te la prendere, io non ho peli sulla lingua e se devo dire qualcosa lo dico, ho alle spalle 20 anni di esperienza in realizzazioni tecniche manuali e di laboratorio... sono diplomato lavoro nel settore elettronico/chimico e non amo vedere certe leggerezze, non per puntiglio ma perchè proprio non possono esserci.
Commenta
-
ciao tecno il giorno 14/09/29013 tu mi scrivi :
io come ti avevo detto, le prove le avevo gia' eseguite , ma solo in modo visivo ,per essere abbastanza sicuro che lo zinco non si corrodesse a contatto di KOH 8M ... purtroppo non avevo fatto prove tecnico/scientifiche di analisi e dimostrazione , quindi sono stato zitto fino ad oggicredimi, anche a 8M mi si consuma, e quando la concentrazione aumenta ancora lo zinco alla fine su ossida completamente in pochi giorni, e mi rimane un pastocco bianco. Parlo sempre di polvere fine, dove la superficie a contatto con l'elettrolita è enorme, e ricorda che non vedrai mai ossido di zinco fino a che il koh è saturo, e nel tuo caso al 50% a voglia ora che si satura....
oggi rispondo con prove scientifiche , il giorno 14/09/2013 pongo a reagire in provetta aperta all'aria 1,5 g di zinco RSE in polvere finissima con 7 ml di KOH 8M RSE .n
Oggi pomeriggio eseguo le analisi del campione .
risultati:
Lo zinco c'è ancora e visivamente non si è consumato , lo strato surnante è limpido ed ad occhio non si notano polveri fini in sospensione e nemmeno precipitati bianchi (anche perche' se ci fossero ZnO oppure Zn(OH)2 sarebbero stati disciolti istantaneamente trasformandosi in zincato di potassio essendo a contatto della potassa 8M ,questo lo so' per esperienza analitica e se non credi alla mia esperienza potrai credere in un libro di analisi chimica pratica . l'ossido e l'idrossido di zinco reagiscono tanto facilmente con acidi che con basi e si dicono anfoteri se non ci credi ti giro un filmatofacendoti vedere che in 1 secondo l'idrossido di zinco scompare a contatto di acidi o basi).
Comunque tornando all'analisi
questa è la provetta contenente lo zinco (1,5 g) e la KOH 8M (si è solo aggregato essendo bagnabile)
Chiaramente se ci fosse dello zinco in soluzione ,come zincato non sarebbe visibile (come dicevi tu) ,difatti hai ragione chiaramente , quindi ho preso il liquido ,l'ho centrifugato a 5500 giri /minuto , ho prelevato 0,5 ml di soluzione con pipetta(errore +- 0,01 ml) di precisione, li ho posti in matraccio tarato da 100 ml ho neutralizzato la potassa in eccesso con HCl diluito a pH 7,5 -8,5 (previa analisi con titolatore automatico ) ,ho portato al volume di 100 con acqua bidistillata .
Dopo di che ho eseguito l'analisi con spettrofotometro nel campo del visibile alla lunghezza d'onda di 625 nm (l' analisi dello zinco è standard ,il metodo è fornito dal produttore ed utilizzato nei piu' comuni laboratori di analisi-chimico cliniche i prodotti sono forniti dallo stesso produttore ed il metodo è a norma CEE ).
Lo spettrofotometro è questo : completamente automatico sia in taratura che nei fattori ed anche nei metodi di analisi (praticamente basta inserire la provetta , lui fa' la lettura della banda a striscie su di essa e parte l'analisi
Il risultato ottenuto è come vedi 3,4 mg/litro di zinco.
espressione dei risultati:
visto che il campione è stato diluito 200 volte (portando 0,5 ml a 100 in matraccio tarato)
1_ il campione non diluito contiene 680 mg/l di zinco (è stato diluito perche' la precisione di questa analisi da' risultati da 0,02 mg/l al massimo a 4 mg/l)
2_ quindi i 7 ml di KOH contengono: proporzione diretta .... 7ml : Xmg = 1000ml : 680mg .... X = 10,294 mg di zinco
come puoi vedere il la potassa ha portato in soluzione solo 10,294 mg di zinco su 1500mg di zinco metallico
in pratica lo zinco che è stato corroso in 7 gg è solo lo 0,68%
l'ossido di zinco che vedevi nella pila quindi era dato dal normale svolgimento delle reazioni chimiche della pila stessa in fase di scarica ...anche perche' se non si formasse ,vorrebbe dire che la pila non genera corrente
Cordialita'
Francy
dimenticavo ....questo è il libro di analisi chimica qualitatitiva pratica .. vedi cosa dice sul grafico
Ultima modifica di Mr.Hyde; 22-09-2013, 16:07.
Commenta
-
Bravo Hyde per la prova.
Ma non era necessario, in quanto lo zinco si discioglie in ambiente acido ma non in ambiante basico.
C'è scritto in tutti i libri di scuola, è un classico. Basta guardare poi i potenziali di ossiriduzione per rendersene conto.
E' ovvio che tracce di Zn si possono purtuttavia discioglire in quanto la purezza assoluta dei componenti in chimica non esiste.
Ma son tracce minime che impediscono con la loro presenza creando una f.em. la ulteriore dissoluzione dello Zn.
Stesso discorso per il rame Cu+ e Cu++ che si disproporziona , formando Cu e Cu2+.
Cu+ + e > Cu 0.52 V (1)
Cu+ > Cu2+ 0.15 V (2)
la semicoppia (1) ha un potenziale più alto della (2) e tende ad ossidare il Cu+ formando Cu++.
Pertanto i sali rameosi si disproporzionano formando 2Cu+ > Cu + Cu++.
Comunque io sto lavorando su un altro tipo di pila al ferro , totalmente ecologica, che non utilizza Cu.
http://www.energeticambiente.it/pile...-al-ferro.html
Il problema delle pile ad aria è la difficoltà di far reagire O2 Che necessita di catalizzatori costosi cha col tempo si drogano e non funzionano più.Ultima modifica di experimentator; 22-09-2013, 16:28.Dante : " Fatti non foste a viver come bruti .... "
Commenta
-
ma no dai Zag se leggi la prima pagina di quella foto che ho fatto c'è scritto che viene attaccato anche dagli idrati alcalini ....ufff non hai neanche ingrandito la foto ... hahaha , in molti casi pero' la concentrazione troppo elevata diciamo che agisce da inibitore sul coefficiente di dissociazione (attivita' ionica) quindi rallenta tantissimo la corrosione .
... hahaha , in molti casi pero' la concentrazione troppo elevata diciamo che agisce da inibitore sul coefficiente di dissociazione (attivita' ionica) quindi rallenta tantissimo la corrosione .
va bè
si ho visto il thread sulla pila chimica al ferro bella idea ... avevo delle domande da farti , ma le faccio di la'
... avevo delle domande da farti , ma le faccio di la' 
Commenta
-
ciao Fra, evidentemente è probabile che nel mio koh o nello zinco sono presenti impurità che favoriscono una rapida ossidazione, questo non lo avevo considerato ed è possibile in quanto non sono di grado tecnico o farmaceutico, ma puramente industriale, in particolar modo il koh che me lo danno per un 96% di purezza, mentre lo zinco si attesta al 99%. Ad ogni modo complimenti per la perfetta analisi, finalmente qualcosa di bello! Che vuoi che ti dica, ormai i test che dovevo fare li ho fatti, è tutto esposto e molto chiaro, anche in questo caso per ottenere risultati migliori è necessario entrare in fasi di lavorazione dei materiali per cui non ho attrezzature e strumentazioni adeguate, per tanto come al solito io mi fermo qui... se qualcuno riuscirà a realizzare questo elettrodo da 465mW/grammo sarà un successo enorme, si parla di 465 watt per chilo, ineguagliabile credo....
Riguardo l'affermazione di zaga, dove sostiene "Il problema delle pile ad aria è la difficoltà di far reagire O2 Che necessita di catalizzatori costosi cha col tempo si drogano e non funzionano più. " replicherei che tutto dipende dall'efficienza che si vuole ottenere, in quanto già con un singolo cilindretto di carbone attivo per acquari dove mediamente appoggiandolo su un gel solido koh si ha un'area di appoggio non superiore a 24mm, io personalmente ho tirato 15mW/h, il che moltiplicato per 4 fa 60mW per centimetro quadro, utilizzando carboni da 300 euro l'etto e senza catalizzatori potete pure moltiplicare per due, provare per credere...
Commenta
-
ecco tecno , invece quel che manca qui da me sono i trasformatori ed i rilevatori di ampere millivolt etc ...quindi unendo le forze ...io metto a disposizione il lab con reagenti e quant'altro per fare le analisi .... tu puoi mettere oltre alla tua esperienza in campo elettrochimico ...tutte le altre attrezzature
...quindi unendo le forze ...io metto a disposizione il lab con reagenti e quant'altro per fare le analisi .... tu puoi mettere oltre alla tua esperienza in campo elettrochimico ...tutte le altre attrezzature 
Commenta
-
Il problema delle Zn aria o Al aria , stà proprio nell'elettrodo catodico aria, che diventa un elettrodo tipo una pila a combustibile con H2 all'anodo e O2 al catodo. Queste pile come tutti sappiamo sono relegate ad usi spaziali in quanto leggere e costose. Ma non hanno vita lunga , anche loro si deteriorano. Sostituire su una pila normale Zn un elettrodo ad aria significa unire le due tecnologie. Niente di strano o impossibile . Ma i costi lieviteranno a dismisura. Come ho più volte specificato il mio obbiettivo primario è quello di abbassare i costi costruttivi e di materiali, costruendo una PILA semplice, poco costosa ed ecologica, facilmente riciclabile.
Per quanto riguarda questo tipo di pile da voi citate (grafene), molte università se ne stanno occupendo con investimenti di milioni di dollari , altro che spiccioli.
I modi di come ossidare la grafite sono conosciuti da tempo (inizi 1900), fatto sta che ad oggi le migliori batterie che funzionano sono quelle tradizionali, con una chimica robusta e certa.
Sulle Zn aria per quanto ne so, non si è riusciti ancora a fare una accumulatore di carica elettrica robusto ed affidabile come le litio, ma solo batterie single use, fanno percorrere ad un auto 1500km e poi devono essere riciclate.
Il problema delle pile non consiste esclusivamente nella energia disponibile nell'immediato, ma nella possibilità di venire ricaricate migliaia di volte senza subire danni.
Per quanto riguarda lo Zn con OH- , per quanto lenta è uno dei problemi che affligge le batterie allo Zn generando autoscarica della batteria come avviene per tutti i tipi di batterie , Piombo , litio , ecc.
Se la batteria è un accumulare di carica elettrica questo fa parte della energia che viene persa in fase di ricarica o di scarica in quanto la reazione dovrebbe avvenire all'inverso generando da Zn++ , Zn metallico.
Per quanto mi riguarda non mi fido tanto di utilizzare uno degli elettrodi che consuma ossigeno , in quanto in fase di ricarica lo dovrebbe rigenerare .
Per quanto riguarda un uso ecologico (a questo punto divento ecologista), sono contrario ad un utilizzo di tali batterie che consumano ossigeno sottraendolo all'atmosfera e delegando quindi alle piante (deforestazione) il compito di generare ossigeno per far funzionare veicoli , come avviene adesso che bruciamo ossigeno con i combustibili fossili.
Per questo motivo non vedrete negli schemi da me presentati batterie che consumano ossigeno , ma solo batterie redox , tipo quella da me citata al ferro , o Zn-Cu.
Sarebbe un paradosso per un ecologista creare batterie che consumano ossigeno, che dovranno alimentare milioni di auto nel mondo, per combattere le auto a combustibile fossile.
E' come la barzelletta del Sindaco. Sapete qual'è il colmo per un sindaco? Avere una moglie fuori dal comune . Ahahah.
Aggiungo , sapete qual'è il colmo per un ecologista?
Fabbricare auto elettriche che consumano ossigeno.Ultima modifica di experimentator; 22-09-2013, 20:38.Dante : " Fatti non foste a viver come bruti .... "
Commenta
-
Zaga il problema non è l'ossigeno , (altrimenti dovremmo togliere anche tutti i pezzi di ghisa e ferro che ci sono in giro) ma la CO2 prodotta da qualsiasi processo , e non perche' l'ossigeno si abbassa ma perche la CO2 si alza , secondo poi l'ossigeno per il 70 % viene prodotto a livello oceanico ,da microrganismi e alghe. e per il restante dalle piante a terra.
comunque siamo OT in questa sezione
Commenta
-
Perchè siamo OT? Stiamo parlando di una batteria Zinco aria.
Hai idea di quanto ossigeno devi consumare per far funzionare una batteria ad aria? Una cosa è una piccola batteria Zn aria per orologio una cosa è una batteria per auto , moltiplicata per tutte le auto circolanti. Che cosa c'entrano i pezzi di ferro o ghisa esistenti in giro?
Intanto tutti i pezzi di ferro vengono protetti contro la corrosione con la zincatura o nichelatura, ma in ogni caso la formazione di ossido passiva il metallo ed inoltre questo processo ossidativo avviene una volta sola, mentre in una batteria per auto elettrica ricaricabile questo ciclo avviene ad ogni scarica.
Il problema non è solo la CO2, anche l'O2 consumato. Hai idea della massa di materia che si ossida in una batteria da 20kW per percorrere solo 100km ?Dante : " Fatti non foste a viver come bruti .... "
Commenta
-
Ti ripeto che qui siamo OT , comunque il ferro presente nelle rocce ha tenuto l'ossigeno in atmosfera a livelli molto bassi ,fissandolo come ossido ,è solo quando tutti i minerali composti da ferro sono stati completamente ossidati(2 miliardi di anni fa') che l'ossigeno in atmosfera si è elevato a livelli ottimali per la vita di organismi che consumano ossigeno , noi compresi .
Il ferro quindi è stato per miliardi di anni la causa della mancanza di ossigeno in atmosfera . oggi il ferro e sue leghe viene estratto dai suoi minerali negli altiforni , secondo te gli altiforni sono veramente cosi' ecologici?? hai presente cosa crea a livello ambientale una industria siderurgica?
ma il punto fondamentale della questione è questo ... l'ossigeno atmosferico che tu dici essere consumato dalle pile zinco-aria in fase di scarica , ritorna in ambiente nella fase di ricarica ...forse questo non l'avevi considerato Zag
Lo zinco inoltre viene ottenuto industrialmente (oltre che per via termica) , per via elettrolitica (usando quindi fonti alternative esempio pannelli fotovoltaici ) Il ferro no( o almeno oggi non si ottiene cosi'!)Ultima modifica di Mr.Hyde; 23-09-2013, 15:21.
Commenta
-
Lascia perdere la storia passate della terra che non è come dici tu.
L'ossigeno sulla terra è comparso con la comparsa degli esseri viventi vegetali portatori di clorofilla,prima non ce n'era.
Se su Marte ci fosse l'acqua e si potessero coltivare piante verdi , anche su Marte ci sarebbe ossigeno.
Io non conosco una batteria allo zinco che ricaricandola ripristina l'ossigeno iniziale, se tu sei in grado di produrla sei il benvenuto.
Attualmente tutte le pile ad aria consumano enormi quantità di ossigeno. Per fare funzionare un auto elettrica si consuma una quantità di ossigeno spaventosa. Per il momento non ho tempo per fare calcoli ,ma ricordo che supergiù si trattava di 300 m3 di solo ossigeno per 100 km.Cioè una sola auto divorerebbe l'ossigeno di migliaia di persone.
Perciò ti dico che i produttori di batterie per auto elettriche che dovessero adottare tale politica sono dei felloni e dei disonesti che si mascherano di ecologisti. Le batterie attuali al litio almeno rispettano tale concetto e le sostanze portatori di carica sono all'interno della batteria stessa, idem le pile al piombo e quelle NiH ed alcaline.
Che senso ha creare auto elettriche per non inquinare e sottrarre ossigeno all'atmosfra come le auto a combustione?
Se dobbiamo ritornare alle origini , come quando viaggiavamo a cavallo , senza inquinare dobbiamo sostituire il cavallo con qualcosa di ecologico , altrimenti non ne vale la candela.
Gli altiforni possono essere ecologici? Evidentemente no! Ma alcune attività industriali non possono essere eliminate tuot court , ma bisotra trovare soluzioni che riducano i danni da inquinamento .
Chi la pensa diversamente può dirlo, vediamo un po chi si dichiara ecologista e poi in realtà non è .
Questo è il mio pensiero non ti offendere.
SalutiUltima modifica di experimentator; 24-09-2013, 19:37.Dante : " Fatti non foste a viver come bruti .... "
Commenta
-
io non sono di sicuro quelllo che è in grado di produrla e nemmeno ho questa presunzione , ma la standford di sicuro si!Io non conosco una batteria allo zinco che ricaricandola ripristina l'ossigeno iniziale, se tu sei in grado di produrla sei il benvenuto
Un gruppo di ricercatori dell'universita di Stanford ha sviluppato una batteria zinco-ariacaratterizzata da una attività catalitica e da una robustezza maggiori di quelle delle batterie realizzate con i costosi catalizzatori al platino e all'iridio. Il risultato del progetto di ricerca prepara il terreno allo sviluppo di alternative a basso costo alle convenzionali batterie agli ioni di litio largamente utilizzate oggi.
alle convenzionali batterie agli ioni di litio largamente utilizzate oggi.
Hongjie Dai, professore di chimica presso l'università di Stanford e principale responsabile del progetto di ricerca, ha dichiarato: "Vi è sempre stata una crescente domanda per batterie ad alte prestazioni, economiche e sicure per i dispositivi portatili, i veicoli elettrici e altre applicazioni di stoccaggio dienergia . Le batterie metallo-aria offrono una possibile soluzione a basso costo".
. Le batterie metallo-aria offrono una possibile soluzione a basso costo".
Il professore osserva come la maggior parte dell'attenzione si sia concentrata sulle batterie agli ioni di litio, nonostante la limitata densità di energia, i costi elevati e qualche problema di sicurezza. "Con un'ampia disponibilità di ossigeno dall'atmosfera, le batterie metallo-aria hanno drasticamente innalzato la teorica densità di energia rispetto alle tradizionali batterie. Tra queste, l'abbinamento zinco-aria è tecnicamente ed economicamente l'opzione più percorribile" ha affermato Dai. Le batterie zinco-aria combinano l'ossigeno dell'atmosfera e il metallo in un elettrolita alcalino liquido per generare corrente elettrica con ossido di zinco come sottoprodotto. Quando il processo è invertito durante la ricarica, ossigeno e metallo vengono rigenerati.
elevati e qualche problema di sicurezza. "Con un'ampia disponibilità di ossigeno dall'atmosfera, le batterie metallo-aria hanno drasticamente innalzato la teorica densità di energia rispetto alle tradizionali batterie. Tra queste, l'abbinamento zinco-aria è tecnicamente ed economicamente l'opzione più percorribile" ha affermato Dai. Le batterie zinco-aria combinano l'ossigeno dell'atmosfera e il metallo in un elettrolita alcalino liquido per generare corrente elettrica con ossido di zinco come sottoprodotto. Quando il processo è invertito durante la ricarica, ossigeno e metallo vengono rigenerati.
<center id="TWP25" style="color: rgb(0, 0, 0); font-family: Arial, Helvetica, sans-serif; font-size: 14px; line-height: 21px;">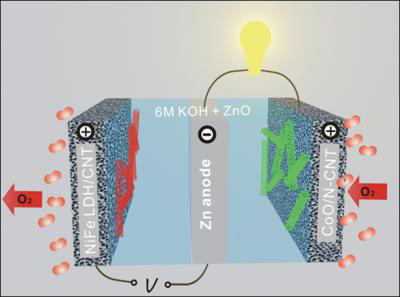 </center>"Le batterie zinco-aria sono interessanti per via dell'abbondanza e del basso costo dello zinco, così come la natura non infiammabile degli elettroliti acquosi che rendono le batterie sicure. Le prime batterie non ricaricabili zinco-aria sono state commercializzate per applicazioni mediche e di telecomunicazioni con una limitata densità di potenza. Lo sviluppo di batterie elettricamente ricaricabili rappresenta comunque una sfida, per via della mancanza di efficienti e robusti catalizzatori d'aria, cosi come il ciclo di vita limitato degli elettrodi di zinco" ha spiegato Dai.
</center>"Le batterie zinco-aria sono interessanti per via dell'abbondanza e del basso costo dello zinco, così come la natura non infiammabile degli elettroliti acquosi che rendono le batterie sicure. Le prime batterie non ricaricabili zinco-aria sono state commercializzate per applicazioni mediche e di telecomunicazioni con una limitata densità di potenza. Lo sviluppo di batterie elettricamente ricaricabili rappresenta comunque una sfida, per via della mancanza di efficienti e robusti catalizzatori d'aria, cosi come il ciclo di vita limitato degli elettrodi di zinco" ha spiegato Dai.
Affinché le reazioni chimiche della fase di scarica e ricarica delle batterie possano avvenire rapidamente è necessario l'impiego di elettrocatalizzatori attivi e resistenti sull'elettrodo. Il gruppo coordinato da Dai ha sviluppato una serie di elettrocatalizzatori ad elevate prestazioni utilizzando ossidi metallici o nanocristalli ibridati con nanotubi di carbonio. Tali catalizzatori sono in grado di produrre un'attività catalitica negli elettrodi alcalini superiore a quella dei catalizzatori realizzati in platino e con altri metalli preziosi.
"Abbiamo individuato catalizzatori simili che incrementano notevolmente le prestazioni delle batterie zinco-aria, ricaricabili e non. L'abbinamento di un catalizzatore in ossido di cobalto con uno in idrossido di nickel-ferro ha come risultato una efficienza energetica da record per le batterie zinco-aria, con una densità di energia specifica più che doppia rispetto a quella offerta dalla tecnologia agli ioni di litio" ha dichiarato Dai.
da record per le batterie zinco-aria, con una densità di energia specifica più che doppia rispetto a quella offerta dalla tecnologia agli ioni di litio" ha dichiarato Dai.
La nuova batteria ha dimostrato una buona reversibilità e stabilità su lunghi cicli di carica-scarica nel corso di varie settimane. "Si tratta di un lavoro che può rappresentare un importante passo avanti per lo sviluppo di batterie ricaricabili zinco-aria, sebbene vi siano una serie di sfide legate all'elettrodo di zinco e all'elettrolita che devono essere affrontate" ha concluso Dai.
legate all'elettrodo di zinco e all'elettrolita che devono essere affrontate" ha concluso Dai.
Chi la pensa diversamente può dirlo, vediamo un pochi si dichiara ecologista e poi in realtà non ènon fare con me questi giochetti ... non mi piacciono prorpio
pensa agli altiforni per produrre ferro che utilizza la tua pila ....e pensa a chi è il finto ecologista !
Commenta
-
Hai capito male non intendevo rivolgermi a te.
Queste pile le hai descritto bene tu , ma sono ancora in fase sperimentale.
Quando le vedremo applicate realmente sulle auto elettriche sarò contento. Ma ancora non ho visto nessuna grossa azienda di auto accaparrarsi tale progetto. Come hai specificato ci sono ancora reali problemi per la durata e l'affidabilità.
Il ferro viene fabbricato una sola volta e può essere riciclato in tanti modi compresa l'energia elettrica e l'energia solare fondendolo con specchi solari a concentrazione .
Non è necessario utilizzare combustibili fossili.
Non ho capito perchè ti stai fissando con questi altoforni. Mica io lavoro negli altoforni che lavorano il ferro.
Se si dovesse fabbricare una pila al ferro il riciclo della stessa può avvenire per elettrolisi o in altri modi parimenti ecologici come ho specificato sopra.
P.S. Analizzando con un rapida occhiata la pila che hai postato si tratterebbe di aumentare il peso della stessa creando in pratica tre elettrodi, con aumento dei costi di produzione e di probabili guasti al sistema. I componenti utilizzati come catalizzatori non mi sembrano proprio il massimo dell'ecologia e ricalcano altri metalli e sali complessi già visti in passato.Ultima modifica di experimentator; 24-09-2013, 20:35.Dante : " Fatti non foste a viver come bruti .... "
Commenta
-
il ferro fonde a 1530 °C! sei sicuro che si puo' riciclare, fondendolo con specchi solari?Il ferro viene fabbricato una sola volta e può essere riciclato in tanti modi compresa l'energia elettrica e l'energia solare fondendolo con specchi solari a concentrazione
sicuro che si tratta di aumento di peso? i nanotubi di carbonio pesano 6 volte meno dell'acciaio e la ricopertura di catalizzatori è minima (superficiale)...sicuro che siano meno ecologiche e pesanti di una pila a ferro?P.S. Analizzando con un rapida occhiata la pila che hai postato si tratterebbe di aumentare il peso della stessa creando in pratica tre elettrodi, con aumento dei costi di produzione e di probabili guasti al sistema. I componenti utilizzati come catalizzatori non mi sembrano proprio il massimo dell'ecologia e ricalcano altri metalli e sali complessi già visti in passato.
Commenta
-
Queste ricerche che hai citato sono ancora in fase sperimentale e sono ancora inaffidabili a lungo termine. Presentano gli stessi problemi dei vecchi catalizzatori, dopo un certo ciclo di funzionamento si guastano. Sono molto pubblicizzati dai giornali ed hanno ottenuto molti investimenti,ma ancora non c'è niente di concreto ed industrializzabile.
Contengono metalli pesanti, pensi che li trovano pronti in natura? o passano attraverso cicli di produzione ed estrazione complicati?
Uno specchio solare può raggiungere temp. anche di 3000 gradi.
Ma non è questo il problema, anche nei catalizzatori che hai citato vi è ferro, cobalto, nikel.
Ma il problema secondo me in assoluto non sta nella diminuizione del peso, ma nella semplicità costruttiva e nei costi totali di produzione e nei costi finali per per l'utilizzatore che alla fine deve spendere un x cifra a chilometro per la mobilità ed ancora nell'impatto ambientale globlale.
I cicli di produzione di questi nanotubi non sono semplici, anzi sono abbastanza complicati , con cicli di produzione non molto puliti , che rilasciano in atmosfera schifezze ...
Non ti fermare solo alla prima impressione e sul risultato finale entusiasmante in apparenza , ma leggiti tutto il ciclo di produzione, per ottenere questi nanotubi o questo grafene.Ultima modifica di experimentator; 25-09-2013, 03:38.Dante : " Fatti non foste a viver come bruti .... "
Commenta

Commenta